О необходимости изменения подходов к оценке классов опасности грунтов-отходов
 Григорьева Ия ЮрьевнаДоцент кафедры инженерной и экологической геологии МГУ им. М.В. Ломоносова, кандидат геолого-минералогических наук, г. Москваikagrig@inbox.ru
Григорьева Ия ЮрьевнаДоцент кафедры инженерной и экологической геологии МГУ им. М.В. Ломоносова, кандидат геолого-минералогических наук, г. Москваikagrig@inbox.ru Федосеева Елена ВасильевнаАссистент кафедры биологии педиатрического факультета Российского национального исследовательского медицинского университета имени Н.И. Пирогова, кандидат биологических наук, г. Москваelenfedoseeva@gmail.com
Федосеева Елена ВасильевнаАссистент кафедры биологии педиатрического факультета Российского национального исследовательского медицинского университета имени Н.И. Пирогова, кандидат биологических наук, г. Москваelenfedoseeva@gmail.com
На сегодняшний день подходы к определению классов опасности грунтов-отходов, в том числе методы экотоксикологических исследований на основе реакций живых организмов, требуют совершенствования. Авторы представленной статьи обосновывают и конкретизируют эту точку зрения на основе не только общих рассуждений, но и собственных экспериментальных данных.

Введение
Загрязнение окружающей среды чужеродными для нее токсичными веществами антропогенного происхождения приобретает все более угрожающий характер для будущего биосферы и человечества. Однако развитие методов контроля и прогнозирования ее состояния, необходимое для решения этой фундаментальной проблемы, пока сильно отстает от указанных негативных изменений, поэтому требует особого внимания.
Для диагностики состояния окружающей среды необходимы в том числе экотоксикологические исследования, которые начали проводить еще до середины XX века. В настоящее время известны различные подходы к оценке загрязненности воздуха, воды, грунтов и отходов. Главный из этих подходов до сих пор основан на системе предельно допустимых концентраций (ПДК), соответствующие нормативы по которым возникли в нашей стране еще в 1930-е годы.
На фоне использования норм по ПДК все больше набирает силу биотическая концепция нормирования вредных воздействий на природные комплексы. Выполнение экотоксикологических исследований было у нас законодательно закреплено в 1986 году для контроля качества сточных и природных вод. Так, тесты с использованием дафний (мелких пресноводных планктонных рачков) обязательны в России при установлении ПДК отдельных веществ в рыбохозяйственных водоемах.
Утверждение Министерством природных ресурсов в 2001 году «Критериев отнесения опасных отходов к классу опасности для окружающей природной среды» (на основании приказа МПР № 511) привело к широкому практическому использованию биотестов в России. С учетом накопленного в этом отношении опыта указанный документ в 2014 году был обновлен (в соответствии с приказом МПР № 536 «Об утверждении “Критериев отнесения отходов к I–V классам опасности по степени негативного воздействия на окружающую среду”» [3]).
В настоящее время для экологического контроля применяются метрологически аттестованные методики, включенные в Федеральный реестр МВИ (методик выполнения измерений) [9]. И их правильный выбор при проведении экотоксикологических исследований (биотестирования) чрезвычайно важен. В этом отношении имеется множество дискуссионных вопросов, в том числе проблема корректности выбора тест-организмов из большого количества живых существ [1]. Тут необходимо помнить, что чувствительность представителей различных биологических видов к разным токсикантам и их сочетаниям зачастую весьма неодинакова.
В общем виде биотестирование представляет собой выявление токсичности проб тех или иных сред по признакам изменений жизненно важных функций тест-организмов независимо от того, какие вещества и в каком сочетании вызывают эти изменения [5]. Например, при оценке качества пресной и морской воды в ряде стран, в том числе в США, предусматривается использование не менее 8 и 16 биологических видов соответственно [1]. В России же, например, для анализа токсичности водных вытяжек с помощью биотестирования нормативные документы предписывают использовать всего лишь не менее 2 видов организмов, да и то только гидробионтов [3].
Совершенно очевидно, что на сегодняшний день методики экотоксикологических исследований разных сред (поверхностных, подземных и сточных вод, донных отложений, почв, подпочвенных грунтов, отходов производства и т.д.) на основе реакций на них тест-организмов требуют совершенствования.
При инженерно-экологических изысканиях неизбежно приходится сталкиваться с необходимостью оценки классов опасности грунтов-отходов. При этом в основу экотоксикологических исследований в соответствии с приказом МПР 2014 года № 536 [3] положена такая кратность разведения водной вытяжки из отходов, при которой вредное воздействие на представителей гидробионтов отсутствует.
Грунты представляют собой сложные многокомпонентные системы, включающие минеральные твердые частицы, органические вещества, микроорганизмы, воду, воздух, остатки растений и животных и т.д. (например, рис. 1). Потенциально опасные для живых организмов загрязняющие вещества (экотоксиканты) могут находиться в них в сорбированном виде на поверхности твердых частиц.
Поллютанты из грунтовых систем могут распространяться в окружающей среде не только с водной фазой, но и путем аэрального переноса или при непосредственном контакте с самим загрязненным грунтом. Но значительная, а иногда и большая, часть экотоксикантов может не переходить в водную вытяжку из пробы грунта [2]. Поэтому класс его опасности, определенный только путем анализа такой вытяжки, может не соответствовать его действительной экотоксичности. Это хорошо продемонстрировали, в частности, эксперименты по оценке влияния состава и количества загрязнений в грунте на результаты биотестирования, выполненные в аккредитованной лаборатории экотоксикологического анализа почв (ЛЭТАП) МГУ имени М.В. Ломоносова (рис. 2), об итогах которых и рассказывается в настоящей статье.
![Рис. 1. Пример грунта как сложной многокомпонентной системы [7]](/images/dynamic/img41438.png)

Материалы и методы
Поскольку биотестирование не позволяет без дополнительных исследований ответить на вопрос о том, какие вещества, в каких сочетаниях и количествах вызывают изменения жизненно важных функций тест-организмов, решалась обратная задача – фиксировались реакции представителей некоторых биологических видов на известные сочетания и концентрации загрязнителей в грунте.
Для исследований был выбран относительно простой по химико-минеральному составу мелкий кварцевый песок из крупного Люберецкого песчаного месторождения (рис. 3, 4), которое находится в 5 км к югу от железнодорожной станции Люберцы в Подмосковье. Глубина отбора проб составляла 2–2,5 м.

![Рис. 4. Люберецкий песчаный карьер [8]](/images/dynamic/img41441.jpg)
В качестве загрязняющих песчаный грунт веществ использовали зимнее дизельное топливо и хлорид натрия. Кроме того, в ряд проб добавляли лигногумат (гуминовый препарат, или гумат, полученный при ускоренной гумификации растительного сырья, который используется в сочетании с удобрениями в сельском хозяйстве для стимуляции роста растений, а также для мелиорации, детоксикации, ремедиации и рекультивации деградированных почв и других загрязненных грунтов [6, 10]). Для контроля служили образцы грунта с лигногуматом или без него, но без добавления дизельного топлива и/или хлорида натрия. Состав, количество и порядок внесения добавок в грунт указаны в таблице 1.
Таблица 1. Состав, количество и порядок внесения добавок в песчаный грунт

Оценка влияния загрязнений на представителей живой природы проводилась с использованием семян двудольного растения горчица белая, или горчица английская (Sinapis alba), которая характеризуется хорошей всхожестью и при этом высокой чувствительностью к токсичным примесям в грунте, и двух распространенных пресноводных гидробионтов – зеленых водорослей из рода сценедесмус класса протококковых (Scenedesmus quadricauda) и микроскопических ветвистоусых рачков большая дафния (Daphnia magna) (рис. 5).
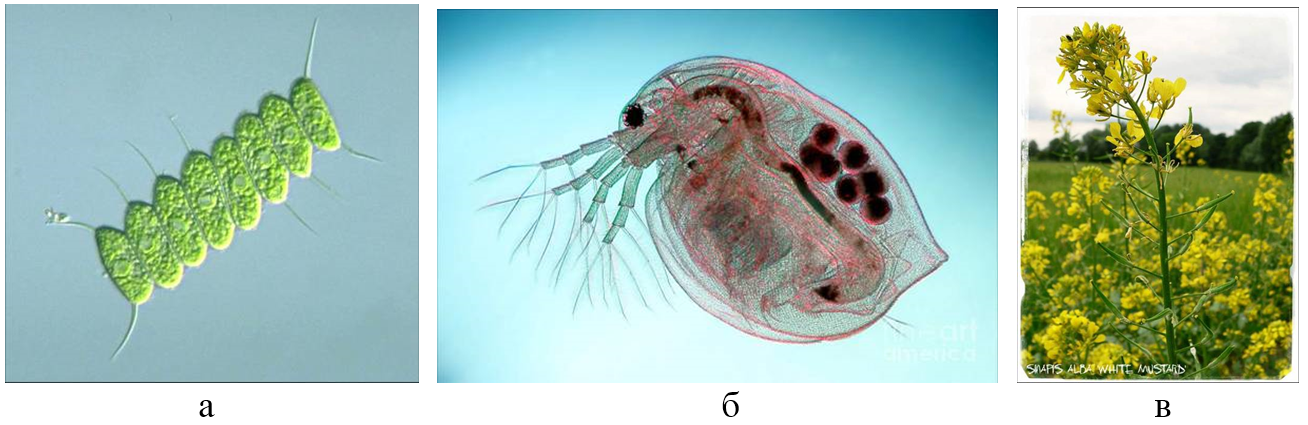
Если для тестов на зеленых водорослях и дафниях применялись только водные вытяжки из образцов грунта (элюатный способ), то для горчицы помимо этого использовалось также непосредственное соприкосновение с загрязненным песком (метод, называемый аппликатным, контактным или субстратным) (рис. 6) [11].
Каждый вариант биотестов выполнялся трижды для последующего усреднения результатов.

Результаты и их обсуждение
Влияние загрязнителей на зеленые водоросли
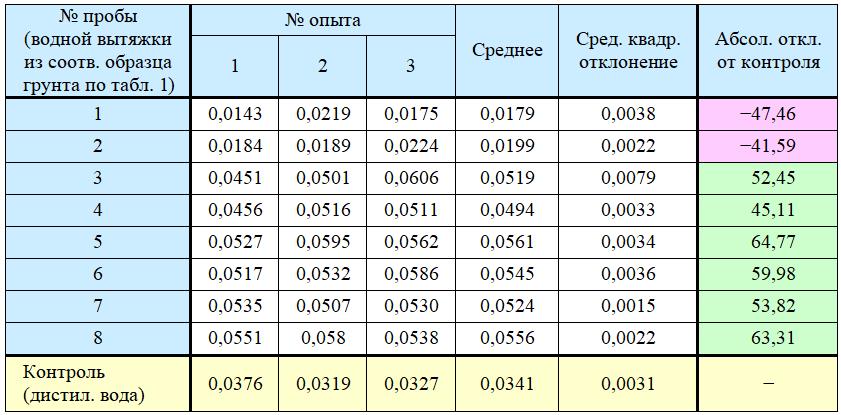
Результаты экспериментов по влиянию водных вытяжек из образцов грунта, приготовленных в соответствии с таблицей 1, на рост водорослей Scenedesmus quadricauda представлены в таблице 2. Из нее видно, что почти все вытяжки стимулировали, а не ингибировали рост водорослей, что может быть объяснено переходом в элюаты ряда органических веществ из песка. Исключение составили вытяжки 1 и 2 – скорее всего потому, что они были получены из песчаного грунта с добавлением лигногумата и отличались из-за этого высокой мутностью, препятствовавшей прохождению света, что и ингибировало рост водорослей. К тому же образец грунта 1 содержал максимальное количество загрязнителей (в отношении их видов и концентраций).
Таблица 2. Интенсивность флуоресценции хлорофилла (усл. ед.) по результатам биотестирования водных вытяжек из загрязненных образцов грунта с использованием зеленых водорослей Scenedesmus quadricauda
Для изучения непосредственного воздействия загрязнителей на водоросли сценедесмус были выполнены дополнительные эксперименты. Данная тест-культура выдерживалась в водных растворах/эмульсиях с соответствующим содержанием добавок в течение 72 часов. Результаты оценки реакции водорослей, представленные в таблице 3, позволяют говорить о наличии сильного токсического влияния на них со стороны поваренной соли и особенно дизельного топлива.
Таблица 3. Интенсивность флуоресценции хлорофилла (усл. ед.) по результатам биотестирования загрязненных образцов воды с использованием зеленых водорослей Scenedesmus quadricauda
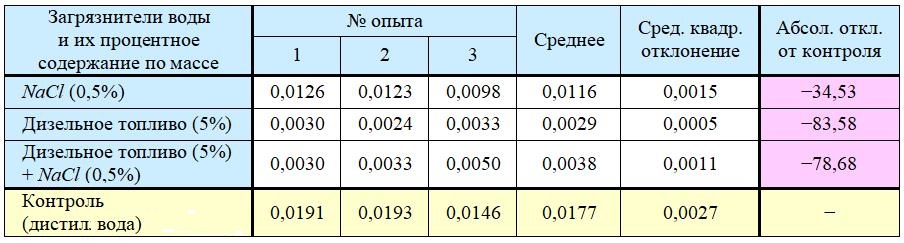
Видно, что результаты, представленные в таблицах 2 и 3, сильно контрастируют друг с другом и подтверждают предположение о том, что для объективной оценки загрязнения и токсичности грунта может быть недостаточно анализа только водных вытяжек из него, по крайней мере для зеленых водорослей Scenedesmus quadricauda.
Влияние загрязнителей на дафний
Помещение ветвистоусых рачков Daphnia magna на 96 часов в водные вытяжки, приготовленные в соответствии с таблицей 1, выявило сильную токсичность всех элюатов (даже из незагрязненных образцов грунта) для данных организмов (таблица 4).
Таблица 4. Процентные доли погибших дафний (%) в водных вытяжках из загрязненных образцов грунта

Очевидно, что дафнии настолько чувствительны к примесям в воде, что вряд ли подходят для биотестирования загрязненности грунтов без использования очень больших разведений элюатов и дополнительных тестирований на других организмах.
Более того, при внимательном рассмотрении таблицы 4 можно заметить явную «нелогичность» полученных данных по выживаемости рачков в зависимости от видов, сочетаний и концентраций загрязнителей (см. табл. 1). Авторы и раньше не раз убеждались в том, что дафниевые тесты не всегда приводят к адекватным результатам. Наблюдения ряда других специалистов также подтверждают это предположение. Но при этом нормативные документы, как уже указывалось в начале статьи, предписывают проведение именно дафниевых тестов, что говорит о необходимости доработки подходов к биотестированию на основе соответствующих исследований.
Влияние загрязнителей на горчицу белую
Фитотестирование загрязненных образцов грунта с использованием горчицы белой (Sinapis alba) элюатным и аппликатным способами оказалось наиболее продуктивным для выводов. Семена этой культуры проращивались в специальных планшетах на подложках, пропитанных водными вытяжками из образцов песка, а также непосредственно на пробах грунта (рис. 7). Через 96 часов после посева оценивались такие показатели, как всхожесть (процентная доля проросших семян, или так называемая энергия прорастания), средняя длина ростка и средняя длина корня.

Усредненные по трем повторностям результаты этих исследований представлены в виде диаграмм на рис. 8–10. Отметим, что нумерация проб в данной серии экспериментов не совпадает с таковой в таблице 1. Пары столбиков, сравнивающие итоги использования аппликатного и элюатного методов, показаны на диаграммах в порядке усложнения/увеличения загрязнения по составу и концентрации. Под каждой парой подписано, какие добавки предварительно вносились в исследованные образцы грунта, а также порядок их внесения.
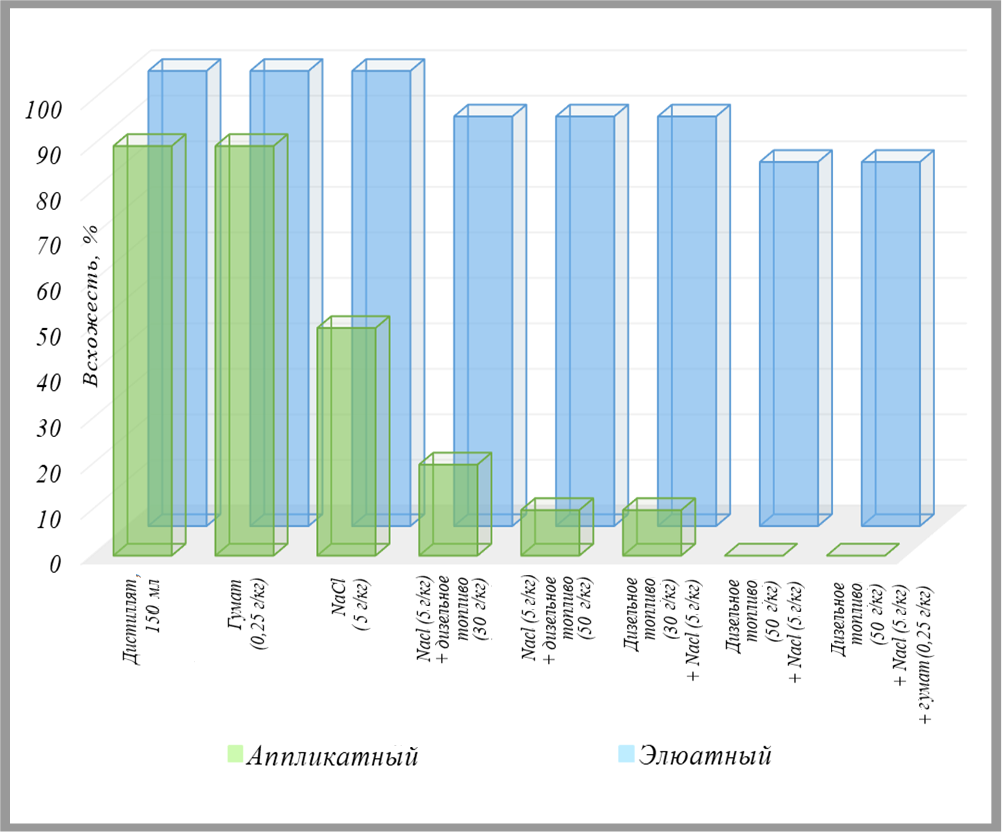
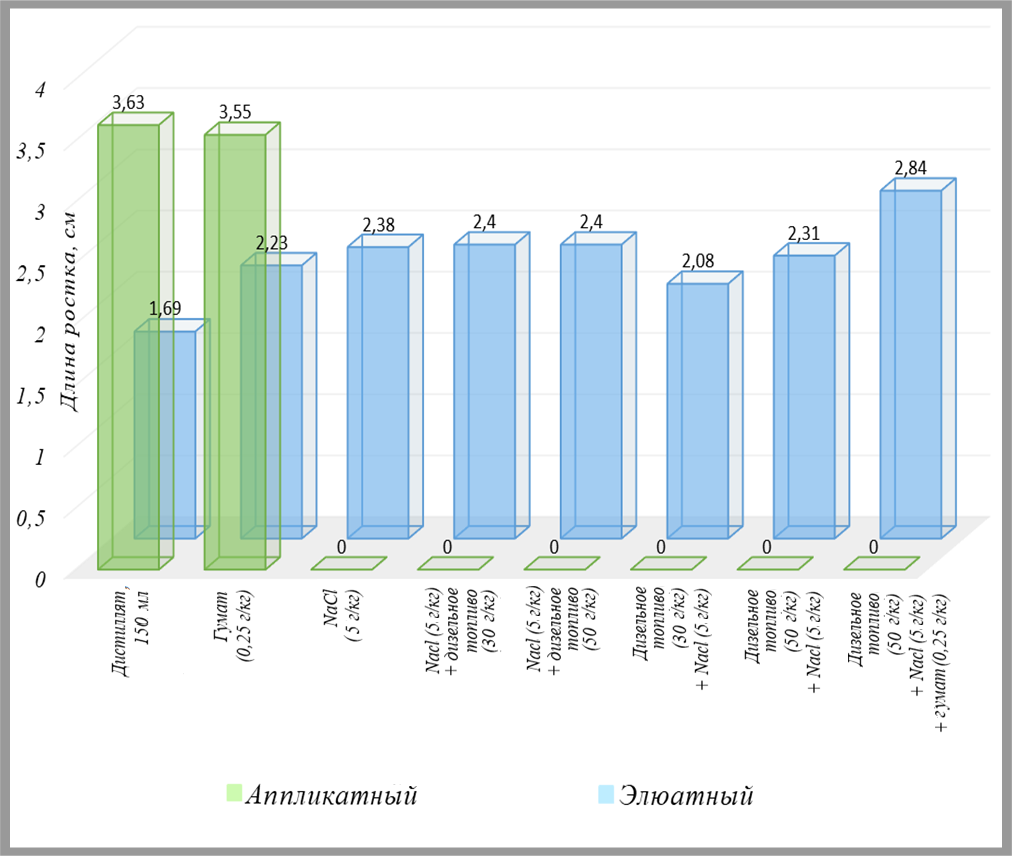
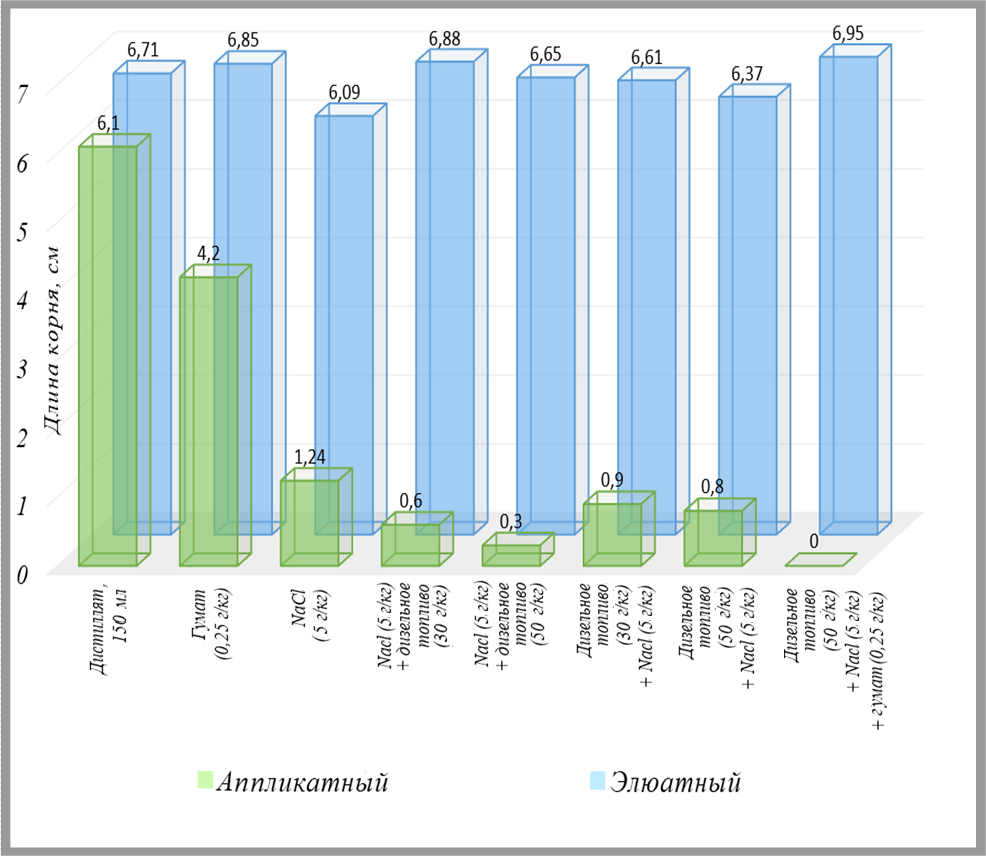
Из рисунков 8–10 видно, что использованные виды, сочетания и концентрации загрязнителей грунта, а также порядок их внесения почти не влияли на тест-параметры в случае применения элюатного способа, но в случае аппликатного метода усложнение состава загрязнения и порядок внесения поллютантов в грунт оказали выраженное воздействие на тест-культуру.
То есть с помощью контактного метода можно получить гораздо более полное и достоверное представление о влиянии выбранных загрязняющих веществ на горчицу белую по сравнению с использованием водных вытяжек. Более того, применение этого растения для оценки токсичности грунта аппликатным способом может дать гораздо более адекватные результаты, чем тесты на рассмотренных выше гидробионтах единственно возможным для них элюатным методом.
Заключение
Хотя до сих пор для экотоксикологических исследований в нашей стране использовались в основном гидробионты [4], результаты проведенных авторами исследований позволяют утверждать, что для более достоверной оценки классов опасности загрязненных грунтов-отходов необходимо расширить набор тест-объектов, причем надо выбирать их не только из гидробионтов, но и из других групп живых организмов, принадлежащих к разным уровням организации.
Биотестирование в отношении образцов загрязненных грунтов необходимо проводить с использованием не только элюатного, но и аппликатного метода (то есть с применением и водных вытяжек, и самих грунтов соответственно).
Авторы убеждены, что оценка классов опасности грунтов-отходов должна базироваться на интеграции химико-аналитических и токсикологических исследований [3], причем вторые должны быть опережающими и определять необходимость проведения первых, а не наоборот, как это в настоящее время предусмотрено действующими российскими нормативными документами.
Список литературы
- Биотестирование в экологическом контроле / под ред. В.А. Тереховой. М.: ГЕОС, 2017. 70 с.
- Григорьева И.Ю. Задачи геоэкологии и грунтоведения при экспериментальной оценке класса опасности грунтов как отходов // Материалы годичной сессии Научного совета РАН по проблемам геоэкологии, инженерной геологии и гидрогеологии «Сергеевские чтения». Вып. 20. Обращение с отходами: задачи геоэкологии и инженерной геологии. М.: Изд-во РУДН, 2018. С. 106–112.
- Приказ Министерства природных ресурсов и экологии Российской Федерации от 04.12.2014 № 536 «Об утверждении критериев отнесения отходов к I–V классам опасности по степени негативного воздействия на окружающую среду». URL: http://publication.pravo.gov.ru/Document/View /0001201512310003.
- Терехова В.А. Биотестирование как метод определения класса опасности отходов // Экология и промышленность России. 2003. № 12. С. 27–29.
- Федосеева Е.В., Сапункова Н.Ю., Терехова В.А. Практическая экотоксикология: оценка чувствительности биотест-культур / под ред. В.А. Тереховой. М.: ГЕОС, 2016. 54 с.
- Якименко О.С., Терехова В.А. Гуминовые препараты и оценка их биологической активности для целей сертификации // Почвоведение. 2011. № 11. С. 1334–1343.
- agripoint.com.pk/brief-introduction-to-soil-and-soil-fertility/.
- fabricators.ru/proizvoditel/lyubereckiy-kvarcevyy-peschanyy-karer.
- fcao.ru/sites/all/themes/fcao/docs/all_questions.pdf.
- lignohumate.ru/primenenie-lignogumata/preparat-lignogumat-otlichitelnye-osobennosti/.
- Persoone G. Recent new microbiotests for cost-effective toxicity monitoring: the Rapidtoxkit and the Phytotoxkit // 12-th International Symposium on Toxicity Assessment: book of abstracts, 2005. P. 112.
Заглавное фото:
Журнал остается бесплатным и продолжает развиваться.
Нам очень нужна поддержка читателей.
Поддержите нас один раз за год
Поддерживайте нас каждый месяц



















